Набор для экстракции и усиления ГМО-урожая
Функции
■ Широкая применимость: этот набор может извлекать высококачественную геномную ДНК из пяти основных ГМО-культур.
■ Просто и быстро: выделение геномной ДНК ГМО-культур может быть завершено в течение 2 часов. Отсутствие необходимости в больших охлаждаемых центрифугах, низкие требования к приборам и оборудованию. Подходит для быстрого выделения геномной ДНК из ГМО-культур на всех уровнях исследовательских институтов.
■ Высокая эффективность и специфичность: уникальный буфер модифицированной антителами полимеразы Taq обеспечивает эффективную амплификацию полимеразы, которая является более специфичной, чем обычная полимераза Taq.
Приложения
Набор может извлекать высококачественную геномную ДНК из основных ГМО-культур, таких как пшеница, кукуруза, рис, хлопок и соя, и выполнять обнаружение трансгенной ПЦР на ГМО-культурах.
Все продукты могут быть настроены для ODM / OEM. Подробности см.пожалуйста, нажмите Индивидуальное обслуживание (ODM / OEM)
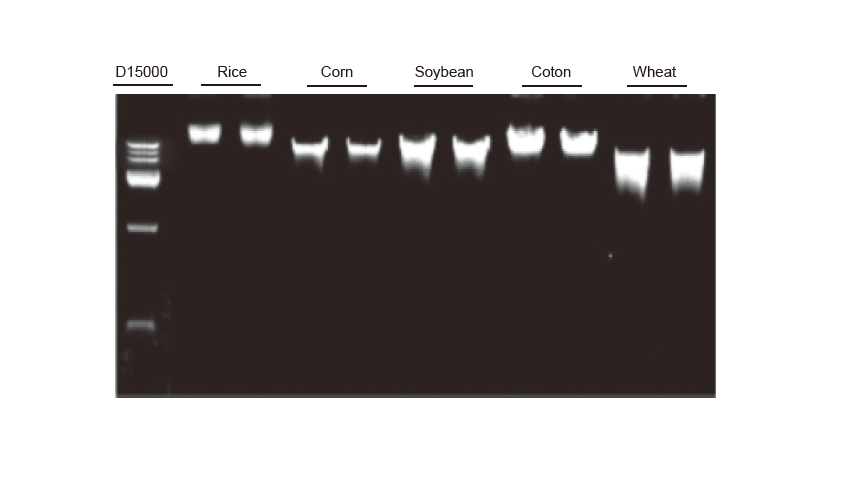 |
Извлечение геномной ДНК Экстракцию геномной ДНК проводили на 100 мг листьев риса, кукурузы, сои, хлопка и пшеницы соответственно. Опыт повторяли дважды. На каждую дорожку загружали 3 мкл ДНК из 100 мкл элюентов. Концентрация агарозного геля составляла 2%. Электрофорез проводили при 6 В / см в течение 20 мин. D15000: ДНК-маркер TIANGEN D15000. |
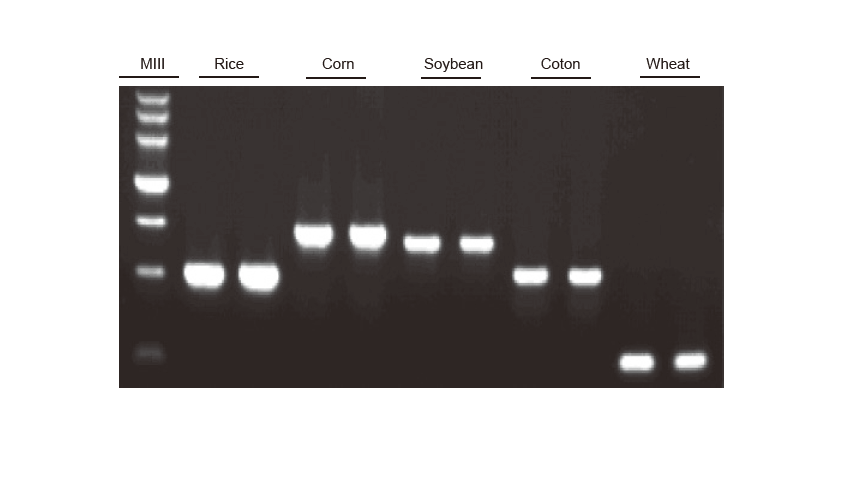 |
Обнаружение ПЦР Геномная ДНК риса, кукурузы, сои, хлопка и пшеницы была амплифицирована соответственно. Опыт повторяли дважды. 6 мкл из общей реакционной системы 20 мкл загружали на дорожку. Концентрация агарозного геля составляла 2%. Электрофорез проводили при 6 В / см в течение 20 мин. D15000: ДНК-маркер TIANGEN D15000. |
Шаблон A-1
■ Шаблон содержит белковые примеси или ингибиторы Taq и т. Д. - Очистите матрицу ДНК, удалите примеси белка или извлеките матричную ДНК с помощью наборов для очистки.
■ Денатурация шаблона не завершена —— Увеличьте температуру денатурации и увеличьте время денатурации.
■ Ухудшение качества шаблона - повторно подготовьте шаблон.
Праймер А-2
■ Низкое качество праймеров - повторно синтезируйте праймер.
■ Разрушение грунтовки —— Разбавьте праймеры с высокой концентрацией в небольшом объеме для консервации. Избегайте многократного замораживания и оттаивания или длительного криоконсервации при 4 ° C.
■ Неправильный дизайн праймеров (например, длина праймера недостаточная, димер образовался между праймерами и т. Д.) -Изменить дизайн праймеров (избегать образования димера праймера и вторичной структуры)
А-3 мг2+концентрация
■ Mg2+ концентрация слишком низкая —— Правильно увеличьте Mg2+ концентрация: оптимизировать Mg2+ концентрация посредством серии реакций от 1 мМ до 3 мМ с интервалом 0,5 мМ для определения оптимального Mg2+ концентрация для каждой матрицы и праймера.
A-4 Температура отжига
■ Высокая температура отжига влияет на связывание праймера и шаблона. —— Уменьшите температуру отжига и оптимизируйте условия с градиентом 2 ° C.
A-5 Время продления
■ Короткое время продления —— Увеличьте время продления.
Явления: отрицательные образцы также показывают полосы целевой последовательности.
А-1 Загрязнение ПЦР
■ Перекрестное загрязнение целевой последовательности или продуктов амплификации - осторожно, не пипетируйте образец, содержащий целевую последовательность в отрицательном образце, и не проливайте их из центрифужной пробирки. Реагенты или оборудование следует автоклавировать для удаления существующих нуклеиновых кислот, а наличие загрязнения следует определять с помощью экспериментов с отрицательным контролем.
■ Загрязнение реагентов —— Смажьте реагенты и храните при низкой температуре.
A-2 Primer
■ Mg2+ концентрация слишком низкая —— Правильно увеличьте Mg2+ концентрация: оптимизировать Mg2+ концентрация посредством серии реакций от 1 мМ до 3 мМ с интервалом 0,5 мМ для определения оптимального Mg2+ концентрация для каждой матрицы и праймера.
■ Неправильный дизайн праймера, и целевая последовательность гомологична нецелевой последовательности. —— Редизайн грунтовок.
Явления: Полосы ПЦР-амплификации не соответствуют ожидаемому размеру, большие или маленькие, или иногда встречаются как специфические полосы амплификации, так и неспецифические полосы амплификации.
Праймер А-1
■ Низкая специфичность праймера.
—— Редизайн грунтовки.
■ Слишком высокая концентрация праймера —— Надлежащим образом увеличьте температуру денатурации и увеличьте время денатурации.
А-2 мг2+ концентрация
■ Mg2+ концентрация слишком высока —— Правильно уменьшите концентрацию Mg2 +: Оптимизируйте содержание Mg2+ концентрация посредством серии реакций от 1 мМ до 3 мМ с интервалом 0,5 мМ для определения оптимального Mg2+ концентрация для каждой матрицы и праймера.
A-3 Термостабильная полимераза
■ Избыточное количество фермента —— Уменьшите количество фермента соответствующим образом с интервалом 0,5 Ед.
A-4 Температура отжига
■ Температура отжига слишком низкая —— Увеличьте температуру отжига или используйте метод двухэтапного отжига.
Циклы ПЦР A-5
■ Слишком много циклов ПЦР —— Уменьшите количество циклов ПЦР.
Праймер А-1—— Низкая специфичность —— Измените дизайн праймера, измените положение и длину праймера, чтобы повысить его специфичность; или выполнить вложенную ПЦР.
ДНК-матрица A-2
—— Матрица не чистая —— Очистите матрицу или извлеките ДНК с помощью наборов для очистки.
А-3 мг2+ концентрация
——Mg2+ концентрация слишком высока —— Правильно уменьшите Mg2+ концентрация: оптимизировать Mg2+ концентрация посредством серии реакций от 1 мМ до 3 мМ с интервалом 0,5 мМ для определения оптимального Mg2+ концентрация для каждой матрицы и праймера.
A-4 dNTP
—— Слишком высокая концентрация dNTP —— Уменьшите концентрацию dNTP соответствующим образом
A-5 Температура отжига
—— Слишком низкая температура отжига —— Увеличьте температуру отжига соответствующим образом
Циклы A-6
—— Слишком много циклов —— Оптимизируйте номер цикла

Первый шаг - выбрать подходящую полимеразу. Обычная полимераза Taq не может быть проверена из-за отсутствия 3'-5'-экзонуклеазной активности, а несоответствие значительно снизит эффективность удлинения фрагментов. Следовательно, обычная полимераза Taq не может эффективно амплифицировать целевые фрагменты размером более 5 т.п.н. Полимераза Taq со специальной модификацией или другая высокоточная полимераза должна быть выбрана для повышения эффективности удлинения и удовлетворения потребностей амплификации длинных фрагментов. Кроме того, амплификация длинных фрагментов также требует соответствующей корректировки конструкции праймера, времени денатурации, времени удлинения, pH буфера и т. Д. Обычно праймеры с 18-24 п.н. могут привести к лучшему выходу. Чтобы предотвратить повреждение шаблона, время денатурации при 94 ° C следует сократить до 30 секунд или меньше за цикл, а время повышения температуры до 94 ° C перед амплификацией должно быть менее 1 мин. Более того, установка температуры удлинения около 68 ° C и проектирование времени удлинения в соответствии со скоростью 1 т.п.н. / мин может обеспечить эффективную амплификацию длинных фрагментов.
Частоту ошибок при амплификации ПЦР можно снизить, используя различные ДНК-полимеразы с высокой точностью. Среди всех обнаруженных к настоящему времени ДНК-полимераз Taq фермент Pfu имеет самый низкий уровень ошибок и самую высокую точность (см. Прилагаемую таблицу). Помимо выбора ферментов, исследователи могут дополнительно снизить скорость мутаций ПЦР за счет оптимизации условий реакции, включая оптимизацию состава буфера, концентрацию термостабильной полимеразы и оптимизацию количества циклов ПЦР.
Категории товаров
ПОЧЕМУ ВЫБРАЛИ НАС
С момента своего основания наша фабрика разрабатывает первоклассные продукты с соблюдением принципа
качества в первую очередь. Наша продукция завоевала отличную репутацию в отрасли и пользуется доверием среди новых и старых клиентов.








